以白云石(化学式表示为MgCO3·CaCO3)[高三][化学]
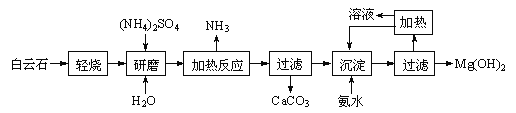
【题目】以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:
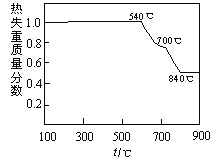
已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:
② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份 _____ (填化学式)。结合上图判断“轻烧”温度应不超过 _____ 。
(2)“加热反应”的化学方程式为 _________________________ 。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)= _______ (已知)。
(4)该工艺中可以循环使用的物质是________(填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石 的方法,其优点是__________________________。
【答案】 CaCO3、MgO 700°C (NH4)2SO4+MgO=MgSO4+2NH3+H2O 5.61×10-3mol/L (NH4)2SO4、NH3或NH3·H2O 减少 CO2的排放。
【解析】流程分析白云石主要成分为MgCO3•CaCO3轻烧,从过滤中可以得到CaCO3来进行判断,分解的只是碳酸镁,研磨加入水和硫酸铵加热,硫酸铵和氧化镁反应生成氨气、硫酸镁和水,过滤加入氨水生成氢氧化镁沉淀,过滤得到氢氧化镁固体;则
(1)从过滤中可以得到CaCO3来进行判断分解的只是碳酸镁,分解生成氧化镁,因此白云石“轻烧”后固体产物的主要成份CaCO3、MgO;从表中可以看出,温度低于540℃时,物质不分解,高于840℃时,碳酸钙和碳酸镁都分解,因此该温度不超过700℃;(2)加热的过程是放出氨气的过程,该过程中因为氧化镁跟水反应很少,因此涉及到的反应应该为:(NH4)2SO4+MgO![]() MgSO4+2NH3↑+H2O;(3)依据溶度积常数计算得到,沉淀过程溶液的pH=9.5,c(OH-)=10-4.5mol/L,c(Mg2+)=Ksp(Mg(OH)2)/c2(OH−)=5.61×10−12/(10−4.5)2=5.61×10-3mol/L;(4)该工艺中可以循环使用的物质是参加反应过程,反应后又生成的物质,流程图分析判断((NH4)2SO4、NH3或NH3·H2O可以循环使用;(5)分析流程可知,传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法可以减少能源消耗、便于CaCO3分离,同时也减少CO2排放。
MgSO4+2NH3↑+H2O;(3)依据溶度积常数计算得到,沉淀过程溶液的pH=9.5,c(OH-)=10-4.5mol/L,c(Mg2+)=Ksp(Mg(OH)2)/c2(OH−)=5.61×10−12/(10−4.5)2=5.61×10-3mol/L;(4)该工艺中可以循环使用的物质是参加反应过程,反应后又生成的物质,流程图分析判断((NH4)2SO4、NH3或NH3·H2O可以循环使用;(5)分析流程可知,传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法可以减少能源消耗、便于CaCO3分离,同时也减少CO2排放。
-
补全下面句子。(任选6空)(1)_,功在不舍。(荀子《劝学》)(2)...[高三][语文]
2021-12-22 -
阅读下文,完成下列小题。上枢密韩太尉书苏辙(1)辙生十有九年矣。其居家所与游者...[高三][语文]
2021-12-22 -
胡萝卜素是一种常用的食用色素,回答下列问题。(1)从胡萝卜中提取的胡萝素中...[高三][生物]
2021-12-22 -
阅读下文,完成下列小题。(1)刘章,汉高祖刘邦之孙,齐王刘肥次子,封朱虚侯...[高三][语文]
2021-12-22 -
家鸡属于鸟纲,是由原鸡长期驯化而来。回答下列问题。(1)...[高三][生物]
2021-12-22
